2月7日,成都生物医药企业康诺亚(HK02162,股价31.60港元,市值88.4亿港元)公告,公司自主研发的1类新药康悦(司普奇拜单抗注射液)获国家药品监督管理局批准上市,用于治疗季节性过敏性鼻炎(SAR)。
这是该药物继2024年9月、12月批准用于治疗成人中重度特应性皮炎、慢性鼻窦炎伴鼻息肉之后获批的第三个适应症。该产品也是全球首个获批治疗季节性过敏性鼻炎的IL-4Rα生物制剂。
从全球市场来看,自免(自身免疫)领域是仅次于肿瘤的第二大药物市场。自免疾病也已成为全球新药开发的热土。2024年上半年,赛诺菲与再生元合作的度普利尤单抗已经成为自免领域新“药王”。
司普奇拜单抗已获批三项适应症
截至目前,康悦达已获批包括成人中重度特应性皮炎、慢性鼻窦炎伴鼻息肉、季节性过敏性鼻炎3项适应症。康悦达也因此成为目前全球首个获批治疗季节性过敏性鼻炎的IL-4Rα生物制剂。
数据显示,我国过敏性鼻炎患病率已从11.1%上升至17.6%,约有2亿患者正在经受疾病困扰。我国13个城市门诊患者临床特征调查显示,持续性中重度过敏性鼻炎患者占比达52.2%。
目前,过敏性鼻炎治疗仍存在巨大的未满足的临床需求。研究表明,即便规律使用鼻用糖皮质激素(INCS)和抗组胺药治疗,仍有62%的中、重度过敏性鼻炎患者症状未能得到有效控制。此外,现有治疗药物存在诸多不良反应,如长期应用鼻喷激素,鼻出血发生率高达20%;抗组胺药常引发嗜睡、鼻眼干燥等问题。脱敏治疗虽然有效,但疗程长达3年,脱落率高,且存在诱发哮喘、过敏反应等风险。生物制剂有望成为中、重度过敏性鼻炎患者的全新治疗选择。
康悦达Ⅲ期临床研究显示,首次用药2天后,鼻塞症状快速缓解;4天后,鼻部整体症状显著改善。相较于鼻喷激素及口服抗组胺药物的联合治疗,司普奇拜单抗组患者每日鼻塞、流涕、鼻痒、打喷嚏的鼻部症状均得到持续显著缓解。第一次治疗后,近一半患者达到轻度甚至完全缓解状态。
此外,首次用药后,司普奇拜单抗组患者每日眼痒/灼热、流泪、眼红等症状均有明显改善。第二次治疗后,近90%患者眼部症状达到轻度甚至完全缓解状态。
康诺亚董事长兼首席执行官陈博对《每日经济新闻》表示:“作为康悦达的第三项适应症,季节性过敏性鼻炎适应症的获批,再一次验证了康悦达优异的临床价值和广阔的开发潜力。随着更多适应症的获批,我们将加速提升康悦达的可及性和可负担性,并继续推动公司在自身免疫性疾病等慢性病治疗领域的深度开发和高效推进”。
康诺亚成NewCo模式出海“专业户”
目前,康诺亚还在探索康悦达针对更多自身免疫性疾病的治疗前景,快速推进包括青少年中重度特应性皮炎、结节性痒疹、哮喘、慢性阻塞性肺病的多个适应症临床研究。
从全球市场来看,自免(自身免疫)领域是仅次于肿瘤的第二大药物市场,公开数据显示,2022年全球相关的药物市场规模约为1317亿美元。自免疾病也已成为全球新药开发的热土。
2021年3月,石药集团(HK01093,股价4.55港元/股,市值525.2亿港元)支付7000万元首付款及1亿元的开发里程碑付款,引进了CM310(司普奇拜单抗研发代号)治疗中重度哮喘、慢性阻塞性肺病(COPD)等呼吸系统疾病的国内权益。康诺亚2024年中报显示,石药集团已经就中重度哮喘及中重度慢性阻塞性肺疾病治疗开展关键Ⅱ/Ⅲ期研究。去年7月,度普利尤单抗已获批了慢性阻塞性肺疾病(COPD)患者的附加维持治疗,成为该疾病首款生物制剂。
根据康诺亚的研发管线,公司还布局了多款自免药物和肿瘤药物。近年来,公司多次通过NewCo模式授权出海回流资金。
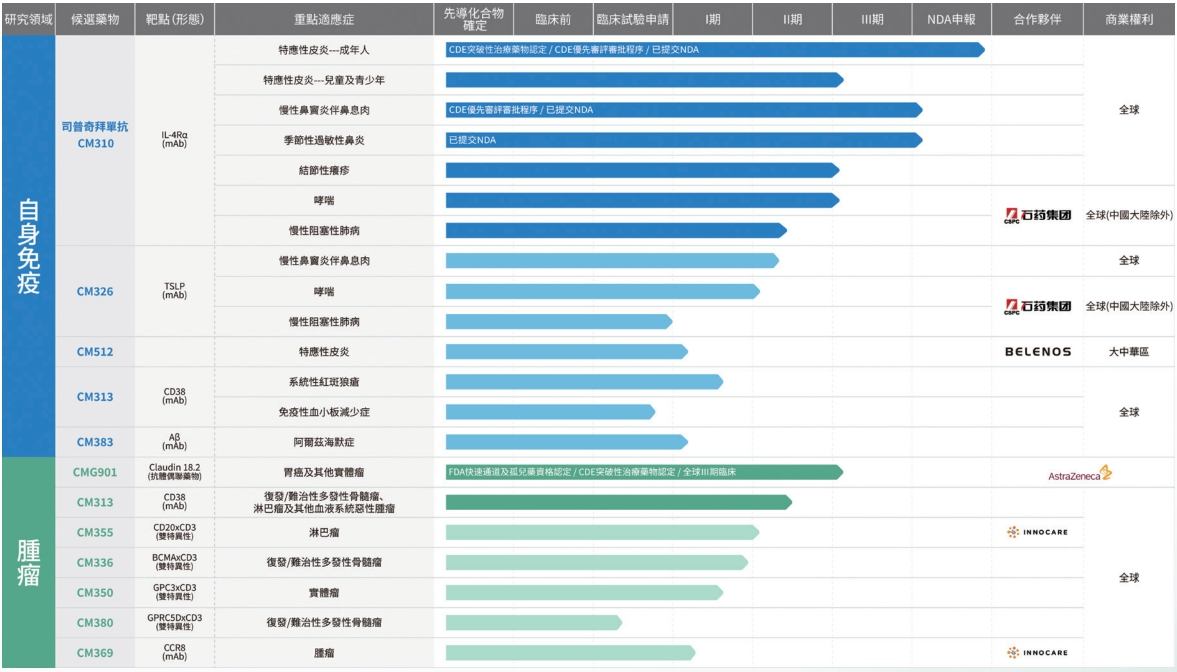
图片来源:康诺亚2024年中报截图
据统计,2024年7月至今,康诺亚四次通过Newco模式达成出海交易。今年1月10日,康诺亚宣布与Timberlyne达成独家授权许可协议,这成为2025年开年来生物医药行业里的第一单NewCo交易。
NewCo模式主要是指由投资基金主导成立新公司,投入资金并组建团队,同时中国本土药企将药物的海外权益授权给该新公司。本土药企除了获得常规的首付款、里程碑付款、销售分成等财务回报外,还可以获得海外新公司的部分股权。Newco模式同时拥有“融资+BD”的属性,但交易的资产往往偏临床早期,首付款也相对比较低。
康诺亚方面此前回复《每日经济新闻》记者书面采访表示,公司选择NewCo模式进行出海,一是根据产品本身的情况,海外的开发会使产品的优势及价值进一步体现,二是通过设立NewCo,可以带动国内的团队一起学习海外产品开发经验,历练团队。“当然我们交易对价上保留了传统授权的付款,这样既可以在短期内收到现金,补充公司现金流,资产的部分在未来NewCo进行其他交易或收并购时也会带来潜在的收益。”
每日经济新闻









发表评论